Les physiciens cherchent à comprendre cette complexité en construisant des modèles qui décrivent les systèmes biologiques à partir de leurs composants fondamentaux et de leurs interactions. Comme ces composants sont nombreux et font intervenir différents aspects physiques agissant ensemble, ces modèles peuvent reproduire le comportement biologique avec plus ou moins de précision, souvent au prix d’une complexité croissante et d’un pouvoir prédictif réduit.
Une manière efficace d’aborder cette complexité consiste à rechercher des principes d’organisation simples qui capturent ce que de nombreux processus ont en commun. L’un de ces principes est que la vie dépend des frontières. Un exemple concret se trouve dans chaque cellule vivante, entourée d’une membrane fragile composée de lipides — des molécules de type graisseux — qui séparent l’intérieur de l’extérieur tout en permettant l’échange et la communication.
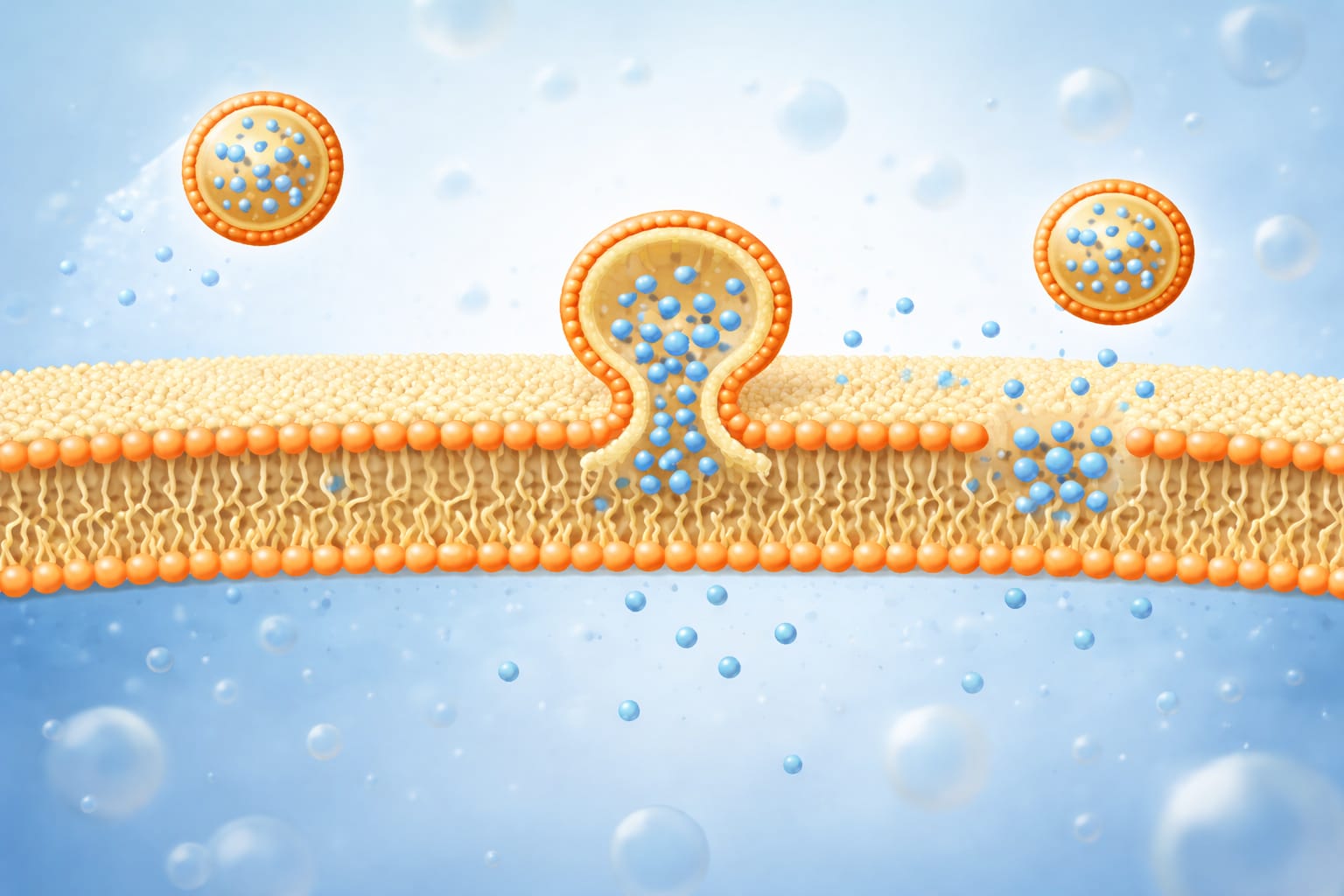
Ces membranes lipidiques sont loin d’être statiques. Elles se renouvellent constamment, les molécules lipidiques se déplaçant lentement d’une membrane à une autre, un processus impliqué dans la communication cellulaire, le remodelage des membranes, l’entrée des virus et le fonctionnement des transporteurs de médicaments à base de lipides. Pourtant, malgré des décennies de recherche, prédire la vitesse de ces échanges — et comprendre pourquoi différentes membranes se comportent de manière si différente — reste un défi majeur.
Dans un article publié dans Small, des chercheurs du laboratoire EST de l’Université libre de Bruxelles, dirigés par Patricia Losada-Pérez et Simone Simon Napolitano, montrent que cette complexité apparente peut en réalité être décrite de manière beaucoup plus simple. Leur travail démontre que la dynamique des membranes peut être résumée par une seule grandeur thermodynamique mesurable.
Cette grandeur correspond à l’expansion d’une membrane lorsqu’elle est légèrement chauffée. Bien que cela puisse sembler être un simple détail physique, il s’avère qu’elle encode à la fois la difficulté qu’a la membrane à se réorganiser et la vitesse à laquelle les échanges moléculaires peuvent se produire. En d’autres termes, une propriété d’équilibre apparemment simple fournit un accès direct à un processus biologique dynamique.
La raison tient à la manière dont les membranes se transforment réellement. L’étude montre que l’échange de lipides n’est pas un simple saut moléculaire d’une membrane à une autre. Il s’agit plutôt d’un processus collectif : un lipide ne peut partir que lorsque de nombreuses molécules voisines se réorganisent ensemble. L’échange se produit lors de rares instants où la membrane s’assouplit brièvement, permettant un mouvement coordonné.
Ce comportement ressemble fortement à ce que les physiciens observent dans les matériaux vitreux, comme les plastiques du quotidien, où les molécules se déplacent par de nombreux petits déplacements coopératifs plutôt que par un flux continu. Développé en collaboration avec des théoriciens américains, le modèle situe les membranes biologiques dans un cadre physique plus large, déjà éprouvé dans d’autres domaines de la physique de la matière molle.
Ce cadre thermodynamique ne se limite pas aux membranes. Le même modèle a déjà été utilisé avec succès pour décrire l’adhésion de molécules sur des surfaces, leur réorganisation au cours du temps et leur cristallisation. Il a ainsi permis de mieux comprendre la stabilité de composés pharmaceutiques et le comportement à long terme de matériaux utilisés en électronique organique — des systèmes pour lesquels la prédiction de réarrangements lents est essentielle à la performance et à la fiabilité. Appliquer cette approche, pour la première fois, à des molécules centrales dans les processus biologiques ouvre la voie à l’extension de ces idées à de nombreux autres mécanismes biologiques, avec la perspective non seulement de mieux les comprendre, mais aussi d’apprendre à en contrôler le comportement.
Référence :
Article complet disponible dans wiley ornidary library
https://onlinelibrary.wiley.com/doi/10.1002/smll.202512844